Michael reaction (✔MR)
Wikipedia: Michael_reaction
- 反応場どうなっとるん。 -
(February 15, 2023)
Keywords: Mukaiyama aldol addition; Michael addition; TBS; carbon–carbon bond formation; asymmetric synthesis; ee; BINOL; hetero Diels-Alder; cycloaddition; Antilla, Jon C.
Enantioselective Mukaiyama–Michael Reaction of β,γ-Unsaturated α-Keto Esters with Silyl Ketene Acetals Catalyzed by a Chiral Magnesium Phosphate (He, Hualing; Shen, Xizhe; Ding, Xinying; Antilla, Jon C.)Org. Lett. 2023, 25 (5), 782–787.
URL (Doi): 10.1021/acs.orglett.2c04277
 |
Michael受容体であるβ,γ–不飽和–α–ケトエステルと、求核剤のカルボン酸エステル由来のシリルエノラートのMukaiyama型反応。反応そのもの、そして反応のエナンチオ選択性を実現するために、光学活性触媒が求められる。その触媒のひとつがこの論文にあるリン酸BINOL–マグネシウムということなのでしょう。
論文のタイトルはMichael付加ですが、要旨テキストにはヘテロDiels–Alder型反応とあり、反応が[4+2]環化付加で進行している可能性「も」あるのだとか。Michael付加でも[4+2]環化付加でもマグネシウム触媒が介在していることは間違いなく、マグネシウム周りの反応場がどうなっているのか気になるところです。マグネシウムが6配位状態を取れるのであれば難しく考えることはないのですが、取れる最大の配位数が4までとなるとリン酸の酸素原子(P=Oのところ)がマグネシウムから離れる必要があるかなと。それって簡単なことなのか、ですね。
 |
そんなわけで、反応機構を知りたく、読みたい論文に追加しました。R2とエナンチオ選択性の関係も。
読みたい論文シリーズ− 2023年1Q
読みたいけと読んでいない論文を、構造式を描きながら紹介します(2023年1〜3月)。
読みたいけと読んでいない論文を、構造式を描きながら紹介します(2023年1〜3月)。
2023年1Qの記事一覧
お仕事関係の記事のリストです(2023年1〜3月)。
お仕事関係の記事のリストです(2023年1〜3月)。
最近の記事
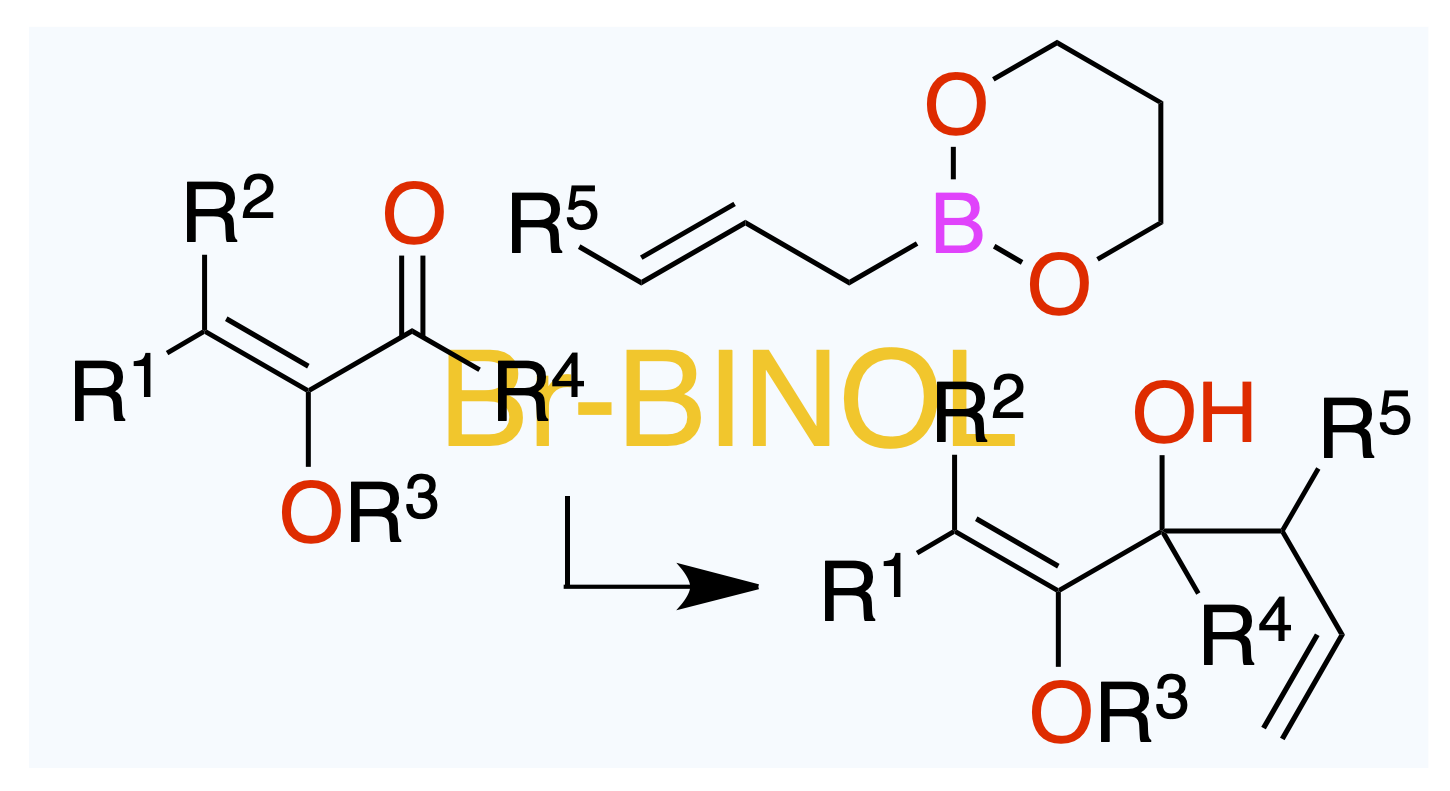
July 11, 2025
1,2–付加でのアリルアルコール経由で。
Org. Lett. 2025, 27 (25), 6557–6560.
Org. Lett. 2025, 27 (25), 6557–6560.
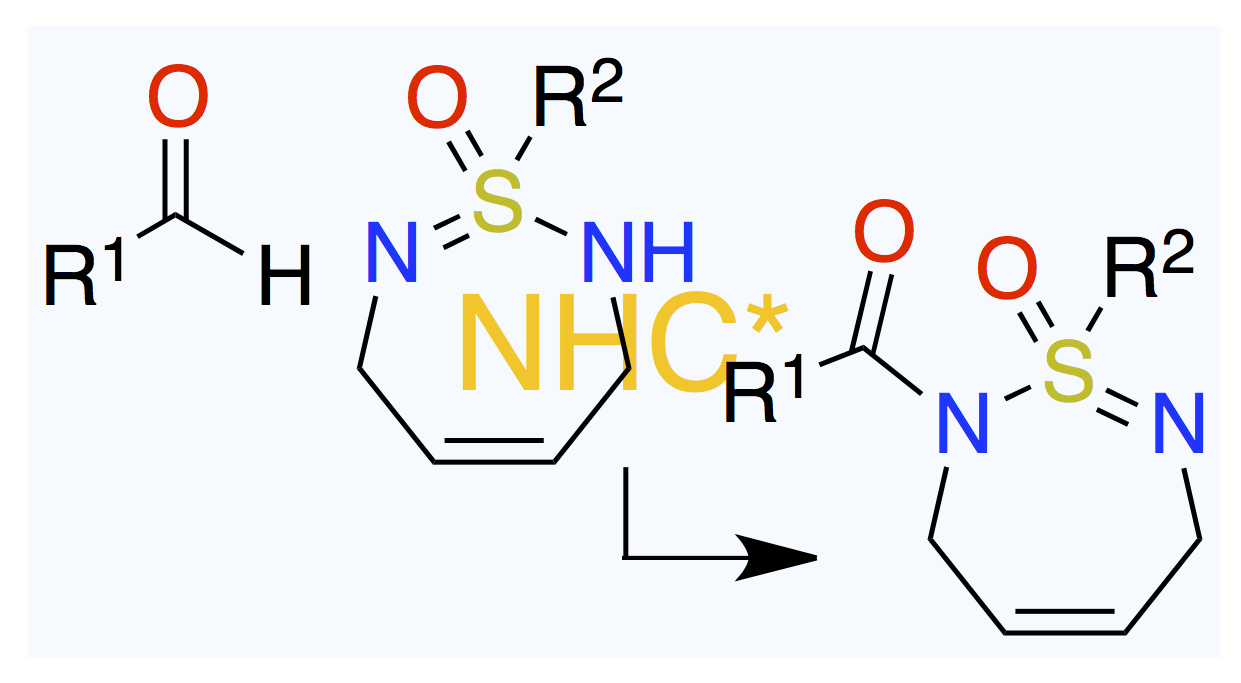
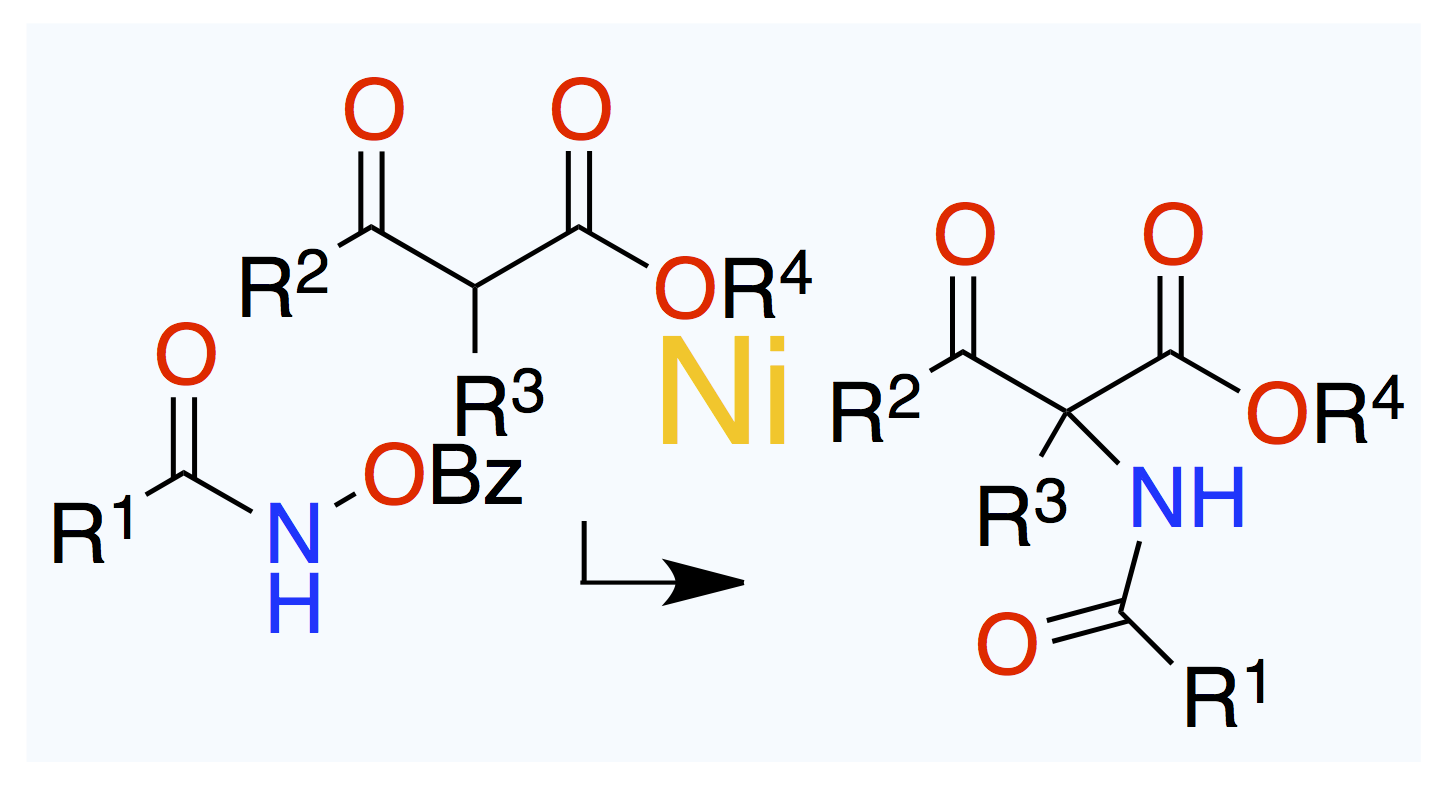
July 9, 2025
元の化合物はキラルかアキラルか。
Angew. Chem. Int. Ed. 2025, 64 (27), e202506929.
Angew. Chem. Int. Ed. 2025, 64 (27), e202506929.
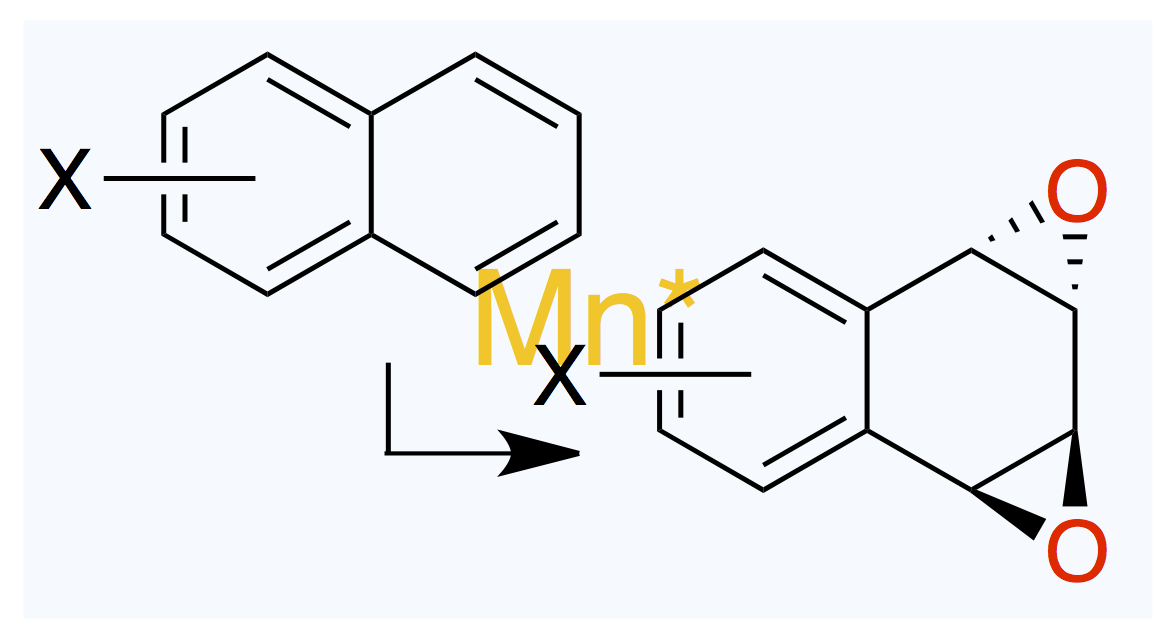
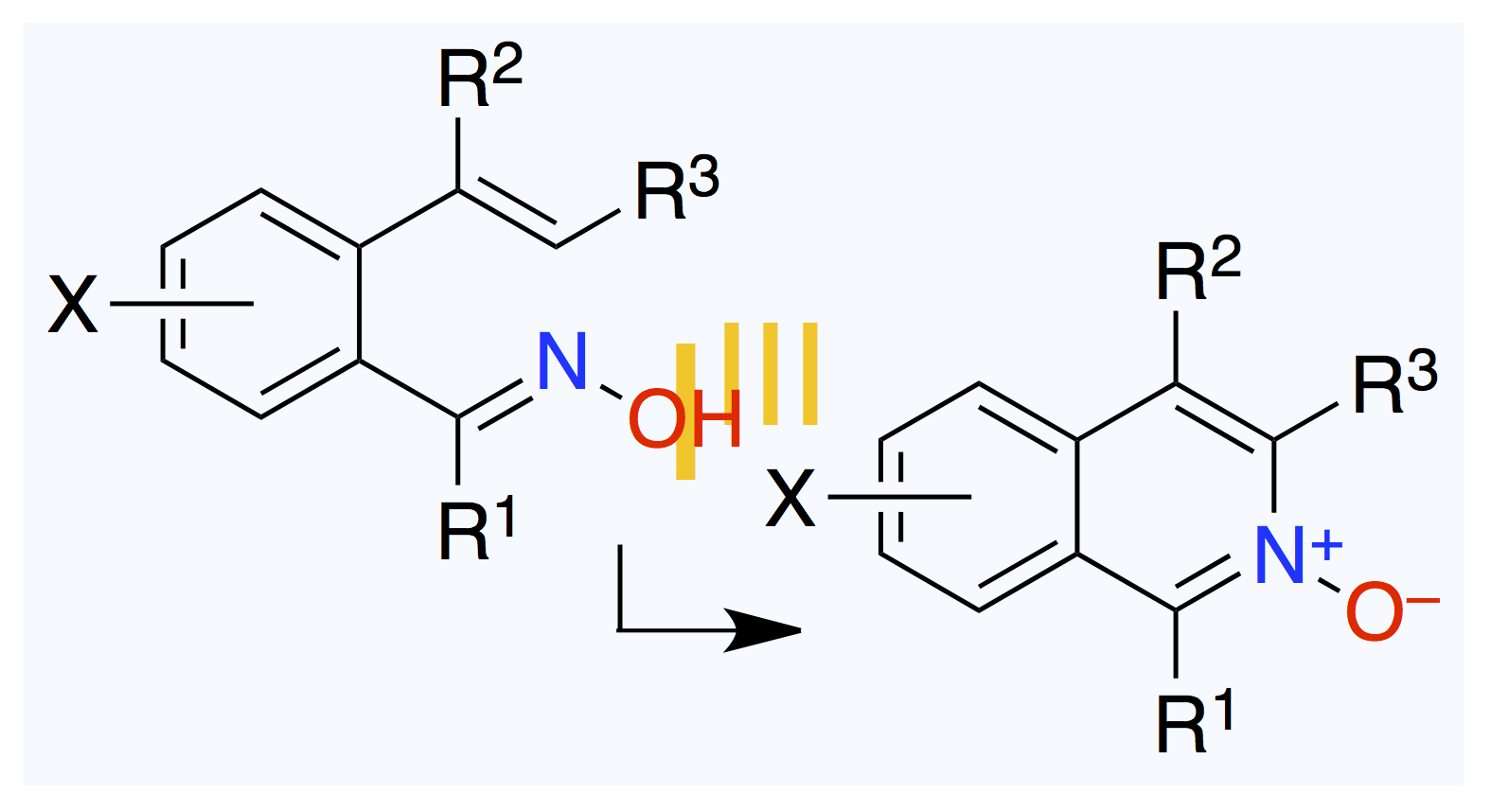
July 3, 2025
脱離基がこいつである必要性。
Org. Lett. 2025, 27 (24), 6368–6373.
Org. Lett. 2025, 27 (24), 6368–6373.
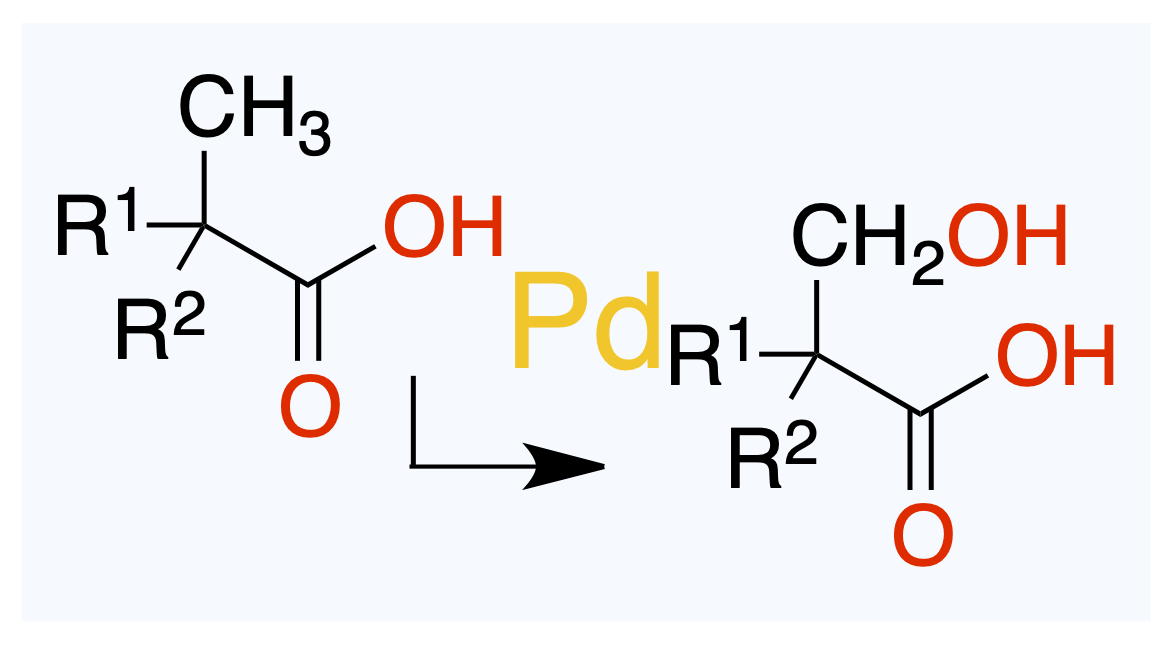
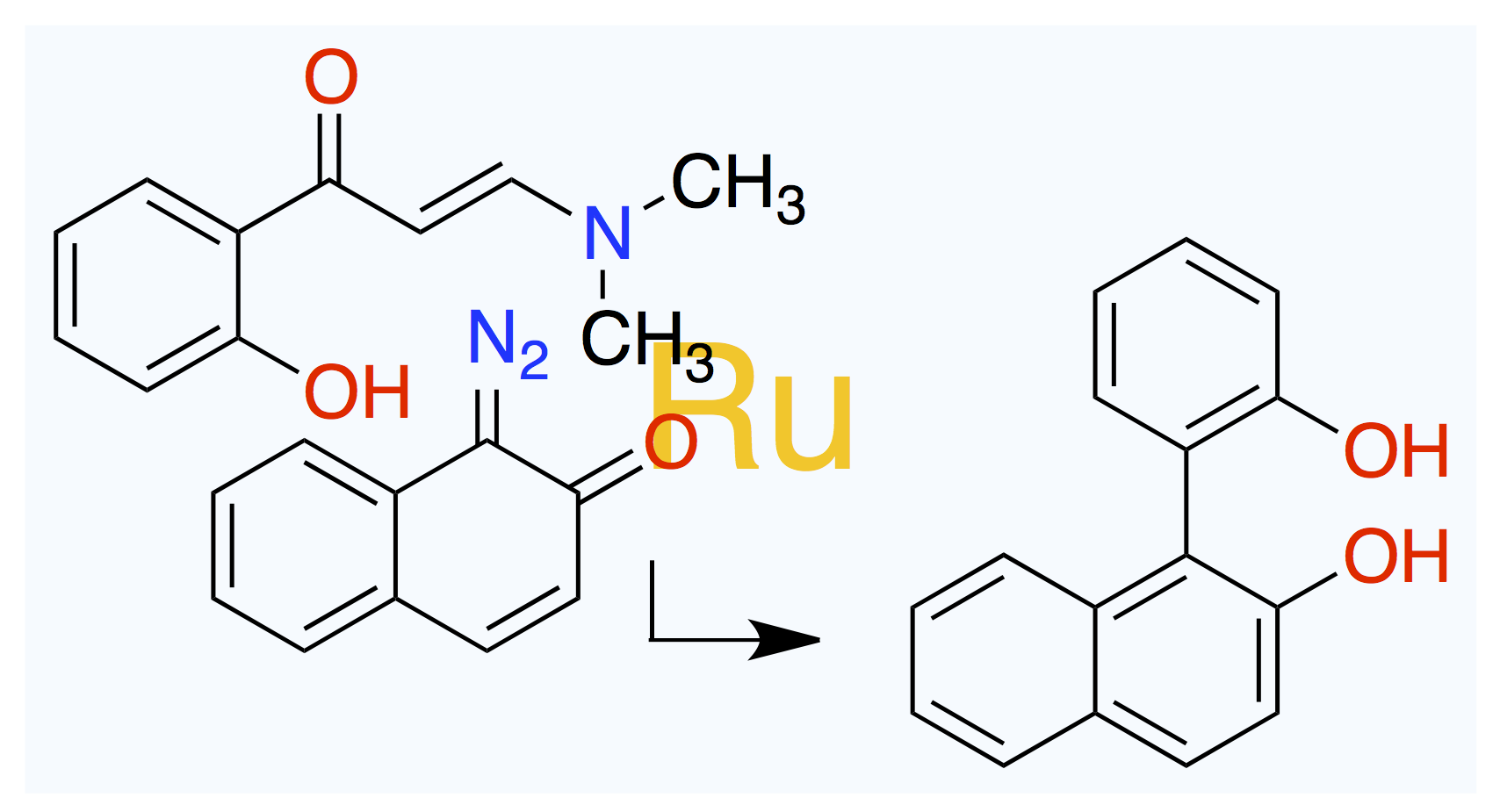
July 2, 2025
カモがネギ背負ってやってくる。
Org. Lett. 2025, 27 (24), 6380–6384.
Org. Lett. 2025, 27 (24), 6380–6384.
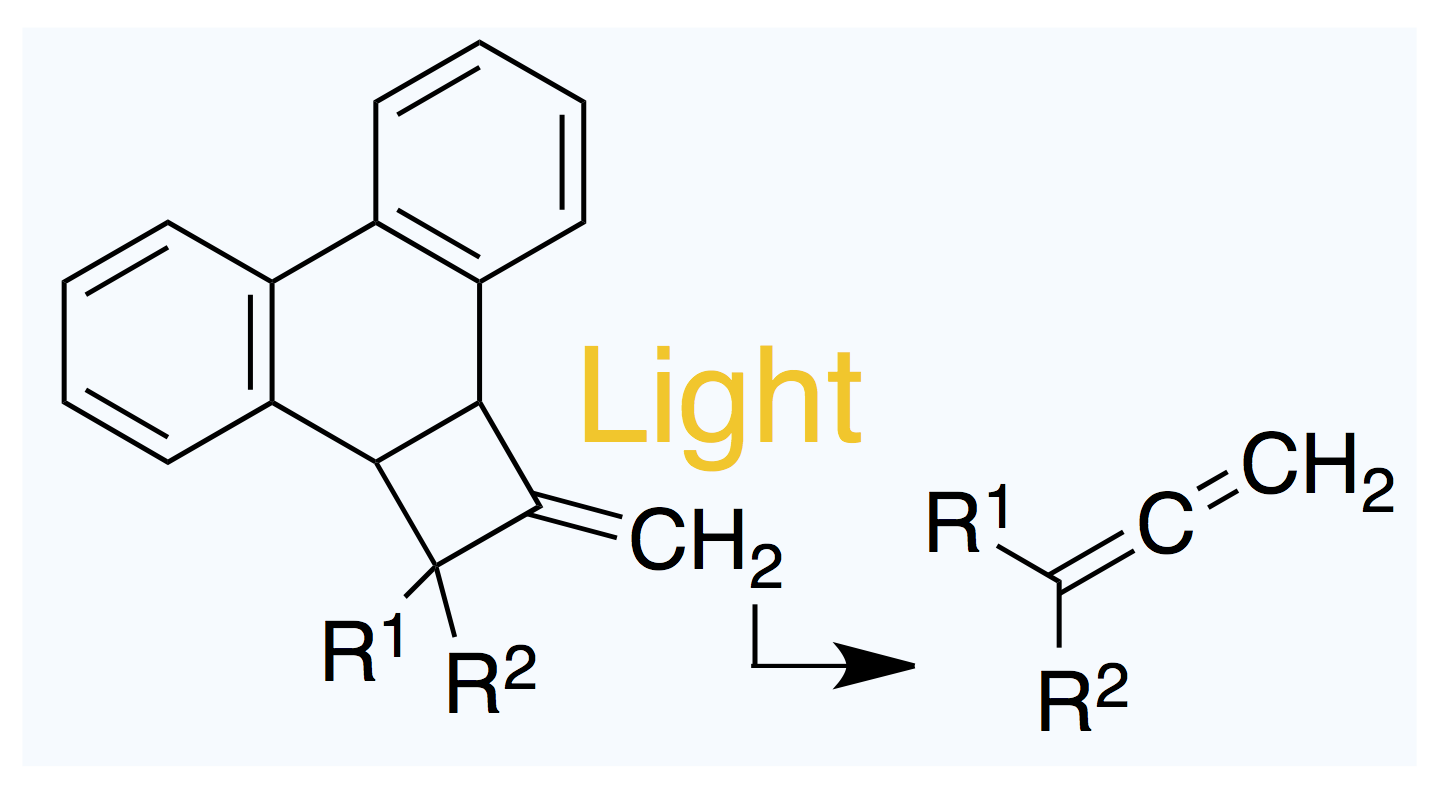
最近よく読まれています
定番の記事








(c) Nanoniele, 2003-
The domain name we own is "nanoniele.jp". We have nothing to do with other domains containing "nanoniele", except "nanoniele.blogspot".
The domain name we own is "nanoniele.jp". We have nothing to do with other domains containing "nanoniele", except "nanoniele.blogspot".
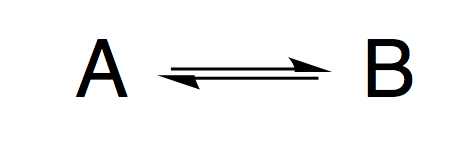
上の化学平衡について、ΔG値からAとBの濃度比を計算します。
(※有効数字は考慮しません)オーナーおすすめ
New 10 terms (July 11, 2025)
(Nanoniele)
https://nanoniele.blogspot.com...



